Brettanomyces, diagnostiquée pour la première fois dans la vallée du Rhône au début des années 2000, pose toujours d’importants problèmes, occasionnant souvent des coûts de traitement importants pour s’en débarrasser. Il est donc nécessaire de disposer de résultats les plus fiables possibles, pour éviter tout sur-traitement et ainsi limiter les coûts.
Dans la presse spécialisée, se sont succédés ces dernières années de nombreux articles dénigrant les méthodes actuelles de quantification de Brettanomyces, mettant en avant leurs faiblesses. Ainsi, la qPCR (Quantitative Polymerase Chain Reaction), largement utilisée depuis 2005, s’est vue reprocher de doser aussi les cellules mortes. La culture sur boîte de Petri (7 jours) ne permet pas de quantifier les cellules en état VNC (viable non cultivable). Dans ce contexte, des méthodes telles que la cytométrie en flux ont émergé. Très mise en avant depuis quelques années, cette technique, bien que très séduisante car rapide, n’est pas le meilleur outil pour quantifier Brettanomyces. Cette technique n’est pas spécifique : il s’agit d’une quantification précise, mais sans distinction de genre ou espèce. Cette technique a été décrite comme spécifique, or, il s’agit d’un simple postulat de départ : il est considéré que si le prélèvement est réalisé en élevage, il ne reste à ce stade que les Brettanomyces. Malheureusement, si souvent les Brettanomyces sont majoritaires à ce stade, les Saccharomyces sont loin d’avoir disparu, avec une forte variabilité selon les domaines. Des kits sont ensuite apparus sur le marché pour rendre spécifique cette analyse par cytométrie. Le principe était prometteur, mais les résultats ont montré les grandes limites de la méthode.
Fort de ce constat, en tant que laboratoire au service des vignerons de la région, il nous fallait disposer d’une méthode rapide, la plus objective possible et surtout, au plus proche du risque réel. Il a été décidé de s’appuyer sur les forces (rapidité, spécificité, répétabilité) de notre méthode actuelle par qPCR et de la faire évoluer. En effet, la qPCR mesure l’ADN, donc les cellules mortes peuvent réagir (cf Le Vigneron des Côtes du Rhône N°874 : Brettanomyces : bien choisir son analyse pour évaluer le risque). Il est souvent considéré que les mortes dénombrées dans ce cas, sont les mortes récentes (depuis quelques semaines). LACO s’est orienté vers la vPCR (Viability Polymerase Chain Reaction) qui est une évolution de la qPCR. Cette technique consiste en un prétraitement d’échantillon, qui va bloquer l’ADN des cellules mortes, qui ne pourra tout simplement plus réagir par PCR. Ne sont alors détectées que les cellules vivantes ou en état VNC. Cette technique de blocage d’ADN existe depuis les années 2000, mais n’avait pas encore trouvé sa place en œnologie.
Des essais ont été menés au LACO pour valider cette technique en comparant trois modalités : la qPCR, la vPCR et la boîte de Petri, en tant que technique de référence. La qPCR donne systématiquement des résultats plus élevés, en moyenne 40% plus élevés que la boîte et 32% que la vPCR.
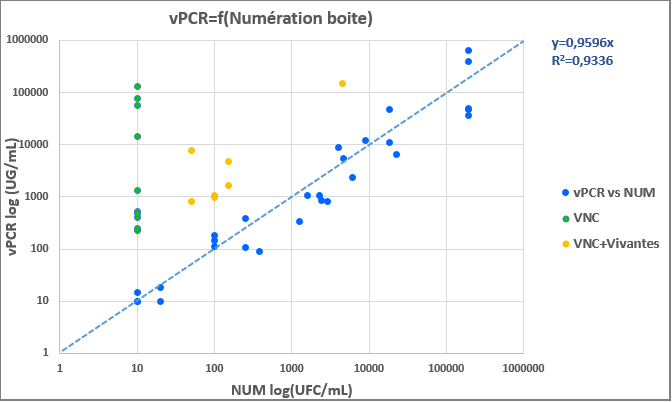
Les résultats peuvent être classés en trois catégories :
- En vert, Les résultats positifs en vPCR mais négatifs par culture sur boîte de Petri : il s’agit dans ce cas des cellules en état VNC. Elles n’ont pas les ressources suffisantes pour croître sur boîte, mais gardent toujours une certaine viabilité, détectée par la méthode vPCR.
- En jaune, les résultats positifs par vPCR et par culture, mais dont les valeurs sont systématiquement plus élevées par vPCR que par culture sur boîte de Petri. Il s’agit de populations mixtes, comportant à la fois des cellules viables, donc détectées aussi bien par culture que par vPCR et des cellules VNC détectées uniquement par vPCR.
- En bleu, les résultats positifs et comparables par culture et par vPCR. Les populations dans ce cas sont viables et ne comportent pas de VNC : la vPCR et la culture donnent des résultats similaires, comme l’attestent la pente et le coefficient de corrélation. Dans le cas présent, il existe une bonne corrélation entre ces deux techniques attestant que la vPCR ne mesure bien que les Brettanomyces vivantes, ainsi que les VNC.
Au LACO, nous disposons donc dorénavant avec la vPCR d’une méthode rapide (analyse en 24H) et fiable, qui permet de détecter autant les cellules viables de Brettanomyces, que les cellules en état VNC. Les cellules mortes ne sont pas prises en compte.
Une application possible est le suivi physiologique des populations de Brettanomyces après un sulfitage. Le SO2 va induire un stress important, voire une mortalité de Brettanomyces.
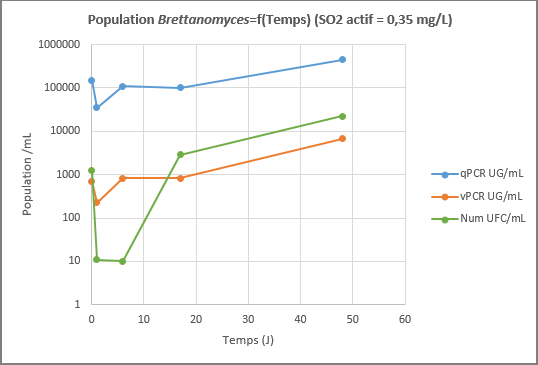
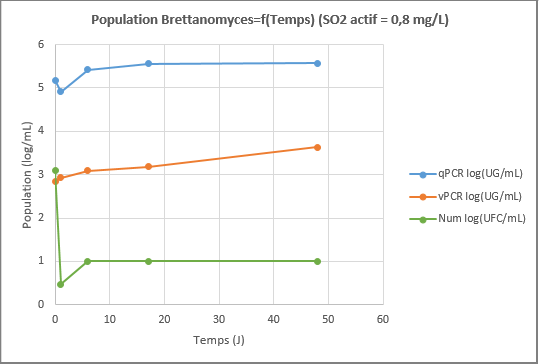
A partir d’un échantillon de vin fortement contaminé par Brettanomyces, deux niveaux de sulfitage sont appliqués : 0,35 mg/L de SO2 actif (environ 18 mg/L de SO2 libre), considéré comme une couverture minimale et 0,8 mg/L de SO2 actif (environ 40 mg/L de SO2 libre), considéré comme la couverture maximale. Les deux vins sont analysés selon les trois méthodes : vPCR, qPCR et numération sur boîte de Petri.
On remarquera que les valeurs par qPCR sont stables, attestant que cette méthode surestime le résultat en dosant les cellules mortes, durant 50 jours dans le cadre de notre essai. Les valeurs de cellules viables et cultivables (numération en UFC/mL) sont faibles et sous-estiment le risque réel du fait du stress lié au sulfitage et donc du passage en VNC d’un grand nombre de cellules. Les valeurs données par la méthode vPCR représentent les populations viables et VNC. Le résultat est logiquement intermédiaire par rapport à la qPCR et la numération.
Cet essai de sulfitage montre que la couverture en SO2 permet de réguler des populations de Brettanomyces. 0,35 mg/L de SO2 actif sont insuffisants pour assurer une protection : en quinze jours, les populations remontent à un niveau problématique. 0,8 mg/L de SO2 actif assurent une bonne protection, mais de nombreuses Brettanomyces VNC restent présents. Le SO2 à dose suffisante est donc un moyen efficace pour contenir Brettanomyces.
En conclusion, la vPCR est réellement une méthode innovante. Rapide (24H), elle permet une juste évaluation du risque Brettanomyces, en écartant les mortes pour ne doser que les vivantes et VNC. LACO met d’ores et déjà cette méthode à disposition des professionnels soucieux de maîtriser ce risque en toute objectivité. Nous prévoyons maintenant de faire également évoluer nos méthodes actuelles de qPCR levures et bactéries vers la vPCR.