
- Œnologie
- 12 / 12 / 2024
Préparation de l'édition du Vin des Voisins 2025
Les laboratoires LACO Analyse & Conseil, LACO Rolland, et Mouriesse invitent les professionnels du secteur viti-vinicole à un...
Suivez les dernières actualités de LACO Analyse & Conseil pour ne rien manquer de notre expertise et de notre savoir-faire.

Les laboratoires LACO Analyse & Conseil, LACO Rolland, et Mouriesse invitent les professionnels du secteur viti-vinicole à un...
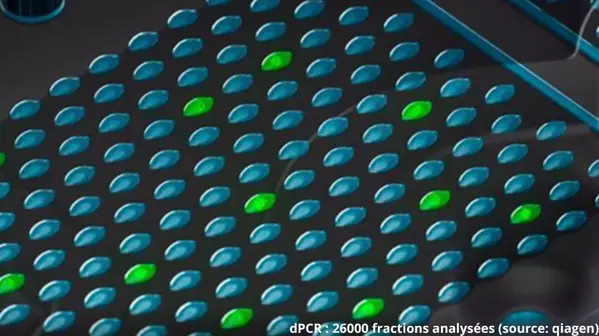
Brettanomyces est toujours la première cause d’altération microbiologique des vins. Durant son développement, cette...

Bulletin Vitioenews comprenant des conseils sur les fermentations sur marc froid, les mises au propre des vins blancs et rosés et un point...

Les principaux points sont les suivants : (voir le lien vers le document complet de la DGCCRF en bas de page) Nouvelles exigences...

Cliquez ici pour voir le bulletin maturité - semaine 34 - 2024

Actuellement, la forte pression du mildiou dans la vallée du Rhône sud oblige les viticulteurs à recourir massivement au...

Les conditions météorologiques actuelles dans la vallée du Rhône sud, avec des cumuls pluviométriques...